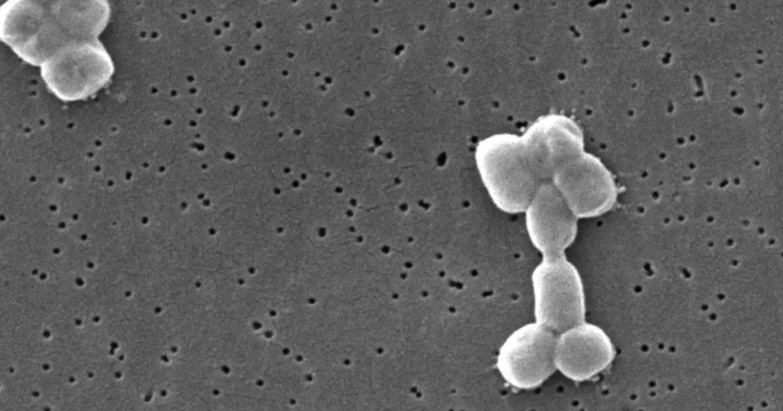
Un estudio publicado en la revista Communications Biology, descubrió por primera vez un ritmo circadiano en una bacteria, la peligrosa Acinetobacter baumannii.
Resulta que esta puede regular su actividad siguiendo los ciclos diarios marcados por la luz y conserva un ritmo propio incluso en la oscuridad.
Los investigadores, creen que este hallazgo puede redefinir cómo comprendemos la virulencia de esta bacteria y cómo resiste a los antibióticos.
Recordemos que, la Acinetobacter baumannii es conocida por causar infecciones graves como neumonía, bacteriemia o meningitis y es considerada un patógeno humano de “alerta roja”, debido a su amplia resistencia a los fármacos.
¿Un ritmo circadiano en una bacteria?
La investigación reveló que esta bacteria no solo percibe la luz azul, sino que organiza su actividad interna siguiendo un ciclo cercano a las 24 horas, similar al de los humanos.
“Significa que esta bacteria no solo responde a la luz, sino que posee un reloj interno capaz de generar ritmos diarios de aproximadamente 24 horas”, explica Luis Larrondo, director del Instituto Milenio de Biología Integrativa (iBio)
De hecho, la actividad biológica de Acinetobacter baumannii sigue ciclos bajo luz-oscuridad y continúa fluctuando incluso sin luz, lo que revela un oscilador circadiano.
De acuerdo con el estudio, el responsable de este fenómeno único hasta ahora es el fotorreceptor BlsA, una proteína que funciona como sensor de luz azul y permite que la bacteria sincronice su ritmo interno con la alternancia entre día y noche.
“BlsA es el principal fotoreceptor de luz azul en A. baumannii y es clave para ajustar sus ritmos circadianos. Sin él, la bacteria pierde coordinación, lo que demuestra que es esencial para sincronizarse, aunque no para generar el ritmo interno”, detalla Larrondo.
Un hallazgo inédito y prometedor
Hasta ahora, se desconocía si es que la biología de las bacterias patógenas humanas se regulaba por los ciclos de luz/oscuridad. Los ritmos circadianos se habían descrito en especies ambientales o fotosintéticas, pero nunca en un microorganismo hospitalario tan relevante.
“Es toda una revolución haber confirmado ritmos circadianos en una bacteria no fotosintética y además patógena, por lo que este hallazgo es extraordinario e inusual”, afirma el investigador.
La bacteria también comparte ciertos rasgos con sistemas circadianos más complejos, como la capacidad de sostener un ritmo interno aún en ausencia de señales externas, pero sigue siendo un misterio cómo funciona molecular su reloj.
“En sistemas como humanos o cianobacterias se conocen los componentes del reloj, pero en A. baumannii no se sabe nada aún. Es apasionante comenzar a descubrir cómo funciona”, comenta Larrondo.
Las implicancias médicas de este hallazgo podrían ser profundas, ya que si procesos como la virulencia, la persistencia en superficies o la susceptibilidad a antibióticos varían a lo largo del día, los tratamientos podrían volverse más o menos efectivos según el momento de administración.
“La evidencia sugiere que estos procesos fluctúan rítmicamente. Lo que viene ahora -y en lo que estamos participando- es entender cómo estos ritmos influyen en la susceptibilidad, la agresividad o la supervivencia del patógeno”, señala el investigador.
Según Larrondo, este hallazgo abre un campo completamente nuevo en el estudio de patógenos humanos, ya que algunas bacterias podrían coordinar su comportamiento no solo con el ambiente, sino también con los ritmos del propio huésped.
“La posibilidad de que ajusten su virulencia o su resistencia según la hora del día plantea un escenario radicalmente nuevo para desarrollar terapias más eficaces y diseñar estrategias que permitan anticiparse a una de las amenazas sanitarias más persistentes de nuestro tiempo”, asegura.
FUENTE: BIOBIO CHILE